脳血管の分子病態研究
脳血管の分子病態研究グループ
人は年を重ねることで、段々と認知機能が低下してきます。
認知機能低下が進むと認知症になり、物忘れなどのために日常生活に支障をきたします。
認知症には色々な因子が影響することで発症することが分かってきております。
我々は、様々な因子の中で認知症と脳血管の異常に注目して研究を進めております。
なぜ脳血管の異常に注目するのか?
我々が考えたり、行動したりすることができるのは脳が「正常」に働いているからです。
脳には神経細胞以外にもグリア細胞など様々な細胞で構成されているのですが、
これらの細胞が適切に機能するためには、適切な量の酸素や栄養素が供給される必要があります。
そして、これら酸素や栄養素は血液によって運ばれます。
しかし、脳全体に酸素や栄養を一様に送ればいい訳ではありません。
脳の活動に応じて、必要な場所に、必要なだけ送る必要があります。
このように脳血流は神経細胞活動に併せて、変化することが知られており、
この血流が神経活動に同期する現象をneurovascular couplingと呼びます。
では神経活動に応じて十分な血液が供給されなかったらどうなるでしょうか?
神経細胞が上手く活動出来なくなってしまいます。
そして、適切な神経活動が維持できなくなり、認知機能低下などの症状として現れます。
この神経細胞の活動に応じた血液供給は、小さな血管(細動脈以遠)によりコントロールされていると考えられています。
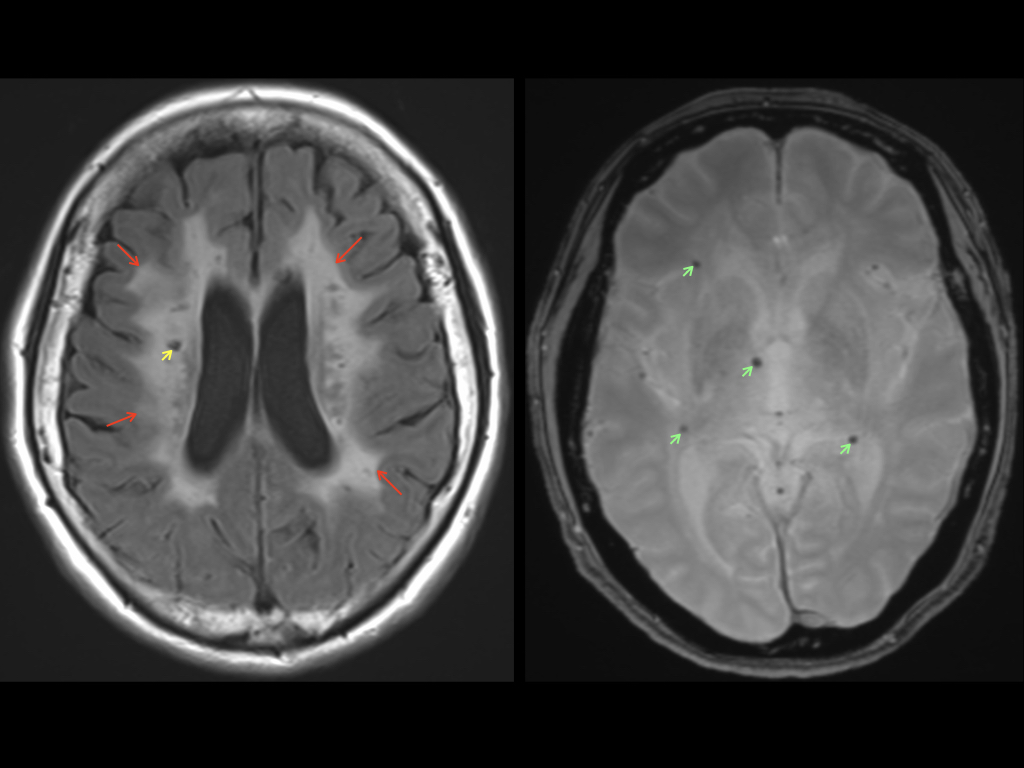
因みに、これらの小さな血管が障害された結果、頭部MRI検査ではラクナ梗塞や白質病変、微小出血などの所見が認められます(図1)。
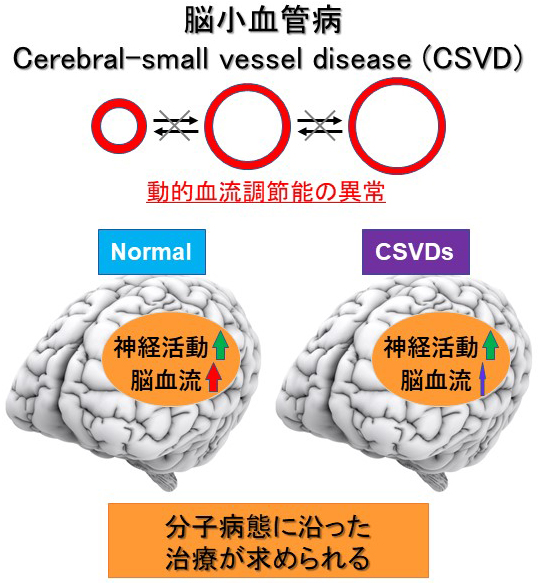
この小さな血管障害により引き起こされる病気を脳小血管病(Cerebral Small Vessel Disease: CSVD)と呼びます。
脳小血管病の分子生物学的機序については分かっていない事が多く、世界中で研究が精力的に進められています(図2)。
図2. 脳小血管病の概念図
遺伝子性疾患から脳小血管病の分子生物学的機序を明らかにする。
我々の教室では、脳小血管病のメカニズムを、CARASIL(cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy)と呼ばれる遺伝性疾患から解き明かそうとしています。
CARASILは遺伝性の脳小血管病であり、その原因遺伝子が、
タンパク分解酵素の一種であるHTRA1(high temperature requirement serine peptidase A1)です。
そのHTRA1の遺伝子に変異が加わると、タンパク分解機能が低下し、CARASILを発症することが分かっています(文献9)。
CARASILや孤発性脳小血管病の患者さんの脳血管では、
HTRA1の分解基質であるtransforming growth factor (TGF)-β1と呼ばれるタンパク質の蓄積を認め、
TGF-β1の過剰が脳小血管病の病態プロセスに関与することが疑われていました。
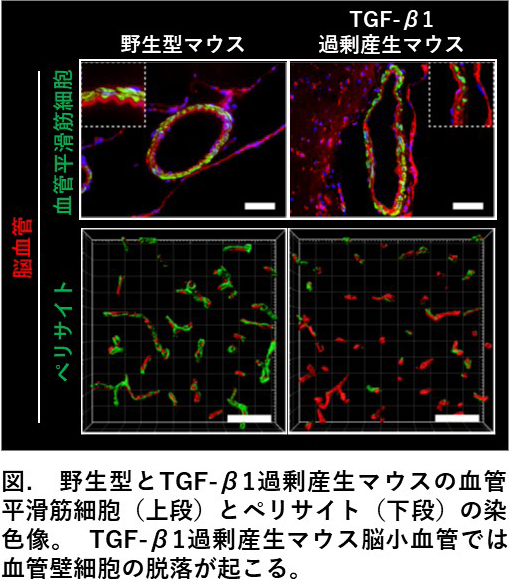
我々は、TGF-β1を過剰産生するマウスを用いて、TGF-β1シグナルの亢進がCARASILや孤発性の脳小血管病の主要な表現型の一つである、
血管壁細胞(血管平滑筋細胞とペリサイト)の変性・脱落を引き起こすことを突き止めました。
血管壁細胞は神経細胞とカップリングして、脳血流量を直接的に制御する細胞であり、
TGF-βシグナル異常の制御は脳小血管病の治療法の開発に繋がる可能性があります(下図)。
CARASIL以外の遺伝性脳小血管病についても探求
遺伝性脳小血管病を引き起こす原因遺伝子は10種類以上知られています。
我々はCARASIL以外の遺伝性脳小血管病について、網羅的な遺伝子解析手法を用いながら解析を進めております。
例えば、COL4A1遺伝子の3’末端非翻訳領域の変異による脳小血管病症例を国内で初めて同定し、国際誌に報告しております(文献3)。
現在も、遺伝子解析を進めながら、日本国内における遺伝性脳小血管病の多様性を解明することを目標に研究を続けております。
発表論文
- Uemura M et al. HTRA1-Related Cerebral Small Vessel Disease: A Review of the Literature. Front Neurol. 2020;11:545. doi: 10.3389/fneur.2020.00545.
- Kato et al. Excessive Production of Transforming Growth Factor β1 Causes Mural Cell Depletion From Cerebral Small Vessels. Front Aging Neuroscience. 2020;12:512-9. doi:10.3389/fnagi.2020.00151.
- Sakai N, Uemura M et al. Hemorrhagic cerebral small vessel disease caused by a novel mutation in 3′ UTR of collagen type IV alpha 1. Neurology Genetics 2019;6:383-4.
- Uemura M, Kanazawa M et al. Role of RNF213 p.4810K variant in the development of intracranial arterial disease in patients treated with nilotinib. J Neu Sci. 2019;408:116577
- Uemura M, Nozaki H e al. HTRA1 Mutations Identified in Symptomatic Carriers Have the Property of Interfering the Trimer-Dependent Activation Cascade. Front Neurol. 2019;10:69-6.
- Nozaki H, Sekine Y, Fukutake T, et al. Characteristic features and progression of abnormalities on MRI for CARASIL. Neurology 2015;85:459-463.
- Nozaki H, Nishizawa M, Onodera O. Features of cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy. Stroke; a journal of cerebral circulation 2014;45:3447-3453.
- Shiga A, Nozaki H, Yokoseki A, et al. Cerebral small-vessel disease protein HTRA1 controls the amount of TGF-beta1 via cleavage of proTGF-beta1. Human molecular genetics 2011;20:1800-1810.
- Hara K, Shiga A, Fukutake T, et al. Association of HTRA1 mutations and familial ischemic cerebral small-vessel disease. The New England journal of medicine 2009;360:1729-1739.