ALSに関する論文が掲載されました
当研究室では,筋萎縮性側索硬化症(ALS)の原因遺伝子であるTARDBPの発現増加を,遺伝子を改変させずに誘導するモデルを開発しました.
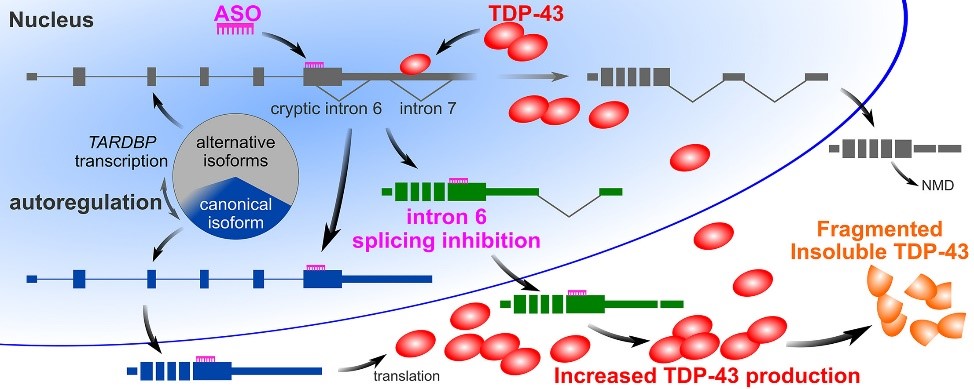
筋萎縮性側索硬化症(ALS)患者の罹患ニューロンでは,核タンパク質であるTDP-43が核から消失し,断片化し,細胞質中に封入体を形成します.これまでに私たちは,TDP-43をコードするTARDBP mRNAがALS運動ニューロンでは増加していることを示していました(Koyama et al., Nucleic Acids Res. 2016).しかし,このTARDBP mRNAの発現増加がALSの病態形成にどのように関与しているのかは,明らかではありませんでした.
私たちは,TDP-43動態を模したin silico modelをもとに,TDP-43病理を伴いTARDBP mRNAの増加をきたす要因のひとつには,TDP-43発現量の自己調節機構の乱れがあることを推測していました(Sugai et al., Front. Neurosci. 2018)(脳研コラム).
そこで今回,TDP-43自己調節に重要な機構のひとつである選択的イントロン6のスプライシングを,アンチセンスオリゴヌクレオチドを用いて阻害しました.その結果,マウス脊髄において,Tardbp mRNA発現が2倍になり,断片化された不溶性TDP-43が増加し,運動ニューロンの数の減少がみられました.ヒトiPS細胞由来ニューロンにおいては,選択的イントロン6のスプライシング阻害はTARDBP mRNAを増加させ,核TDP-43を減少させました.このような遺伝子を改変させずにTARDBP mRNA発現の増加を誘導するモデルの分析結果から,TDP-43自己調節の乱れがALSの病因に関連している可能性が示唆されました.本成果は,2019年7月13日に「Neurobiology of Disease」に掲載されました.